院友风采
现代社会带来的丰富物质和多种多样的美食往往让我们吃下超过我们身体所需要并能承受的食物,进而导致诸如肥胖以及其他各种代谢类疾病,事实上,在代谢类疾病上的花费已经成为主要的社会医疗和福利开支。作为人体的司令部,我们的大脑怎么调控进食,我们为什么吃,为什么不吃,吃多少,这些问题正受到越来越多的关注。
过去的研究表明,哺乳类动物的下丘脑是进食调控的主要脑区。早期的临床病例让我们了解到,外侧下丘脑(lateral hypothalamus)受损的病人往往食欲不振甚至厌食(1, 2),更进一步的动物实验证实外侧下丘脑的确是一个重要的进食调控区域(3, 4)。随着与肥胖相关的基因AgRP(Agouti-related protein)的克隆(5),下丘脑底部的弓状核(arcuate nucleus)及其中的AgRP阳性神经元被发现是进食调控的关键机制(6, 7)。弓状核内AgRP阳性神经元受损的小鼠甚至会把自己活活饿死(8)。那么下丘脑里是否还有另外的独立于外侧下丘脑和弓状核的调控进食的脑区呢?去年发表在Science的一篇文章揭示了下丘脑未定带(zona incerta)在过度进食(binge eating)中的重要作用(9),在本期Science杂志中,来自新加坡科技研究局(A*STAR)的公司98级院友傅玉(Dr. Fu Yu)研究员的团队报道了小鼠里另一个下丘脑的核团,结节核(Tuberal Nucleus, TN),在进食调控中的重要作用,提出了一个全新的进食调控的神经机制。
人类下丘脑的隆起侧核lateral tuberal nucleus,又称nucleus tuberalis lateralis (NTL),是我们大脑内非常特殊的一个结构(图1)。虽然早在1938年出版的下丘脑手册里就已经列出了这个脑区(10),但是关于它的功能直到本期Science之前都还未知。这个脑区长期以来一直被认为是人类和灵长类动物所特有的,虽然在小鼠的下丘脑里有结节核,但这是否是人类NTL的同源脑区一直没有明确的定论(11)。虽然人类NTL的生理功能未知,但在多种神经退行性疾病中,如亨廷顿舞蹈症,人们已经发现NTL存在特异性的病理改变(比如生长激素抑制素somatostatin染色阳性细胞数显著减少)(12, 13),但是NTL部位的病理变化到底带来什么后果还是一个未知的问题。有意思的是,很多神经退行性疾病患者往往伴随食欲的变化或者代谢类疾病。另外,深部下丘脑(靠近NTL)损毁的病人也会出现食欲减退的现象(1, 14)。这些有意思的线索提示这个脑区可能存在与摄食和代谢调控的重要关系。
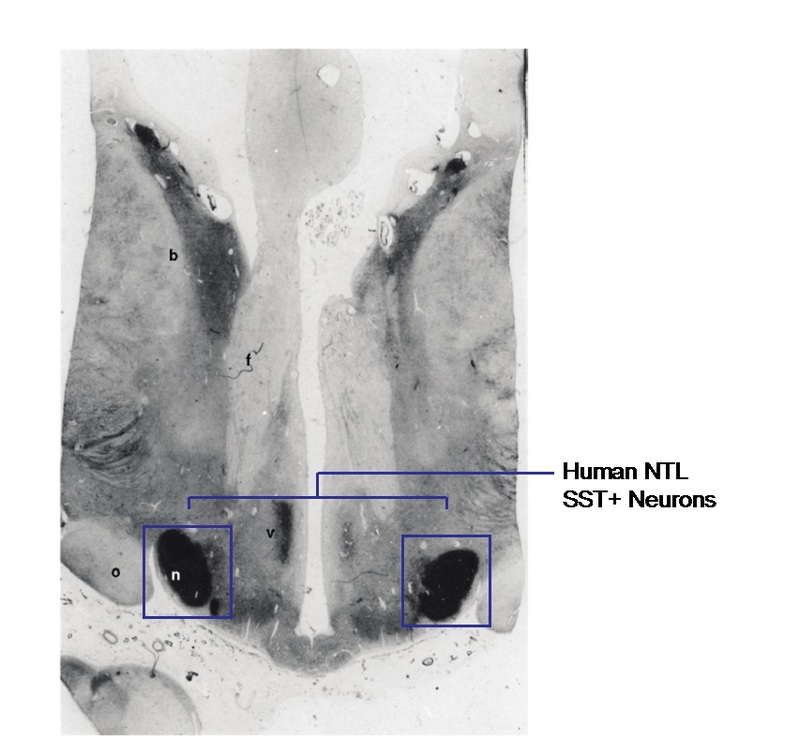
图1:人类下丘脑NTL脑区 SST阳性神经元示意图( modified from Timmers et al. 1996)
在本期Science杂志中,傅玉博士的研究组利用特异性标记somatostatin(SST)阳性神经细胞的转基因小鼠,发现在小鼠下丘脑结节核脑区存在和人类NTL类似的密集的SST阳性神经细胞,给出了小鼠结节核(TN)是人类NTL同源脑区的有力支持,并且第一次发现了结节核内GABA能SST阳性神经元具有调控进食的重要作用(图2)。在饥饿或饥饿素处理的小鼠中,结节核内的SST(TNSST)神经元会被激活。通过光遗传学和化学遗传学手段,激活的TNSST神经元有效地促进小鼠进食;而抑制TNSST神经元则减少小鼠进食。TNSST神经元调控进食的作用主要通过投射到下丘脑室旁核PVN和终纹床核BNST起作用。研究者还发现,消除TNSST神经元不仅减少食物摄取,而且还降低小鼠体重的正常增长。
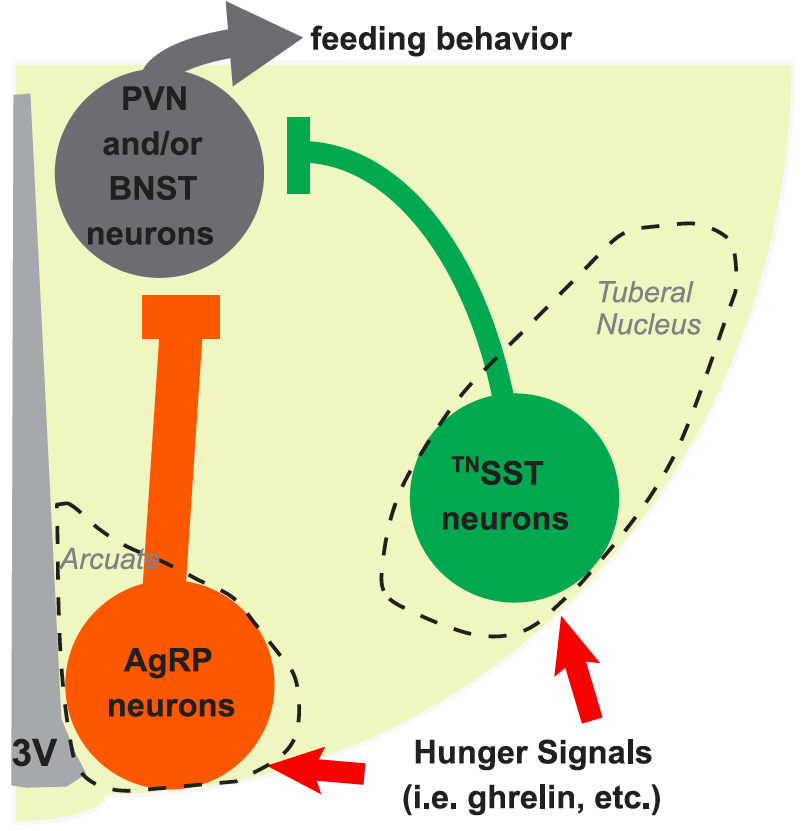
图2: 小鼠下丘脑结节核tuberal nucleus脑区SST阳性神经细胞促进进食模式图
这项研究的重要意义在于:(1)肯定了小鼠存在人类NTL同源结构; (2)第一次揭示了小鼠结节核(tuberal nucleus)的生理功能,同时提示人类NTL的生理功能;(3)揭示了一个全新的食欲调控机制;(4)对神经退行性疾病患者的代谢或食欲变化提出新的理解,可能会更好的提高这些病人的生活质量。
这项研究工作由新加坡A*STAR傅玉实验室的博士后Sarah Luo,上海交通大学医学院研究员黄菊,武汉中科院物理数学研究所副研究员李琴,为共同第一作者,在傅玉研究员的指导下完成。
相关论文:Regulation of Feeding by Somatostatin Neurons in the Tuberal Nucleus (Science 6 JULY 2018: Vol 361, Issue 6397 )
URL:http://www.sciencemag.org/content/361/6397/76
参考文献:
1.L. E. White, R. F. Hain, Anorexia in association with a destructive lesion of the hypothalamus. Arch Pathol68, 275-281 (1959).
2.N. Kamalian, R. E. Keesey, G. M. ZuRhein, Lateral hypothalamic demyelination and cachexia in a case of "malignant" multiple sclerosis. Neurology25, 25-30 (1975).
3.D. L. Margules, J. Olds, Identical "feeding" and "rewarding" systems in the lateral hypothalamus of rats. Science135, 374-375 (1962).
4.B. G. Hoebel, P. Teitelbaum, Hypothalamic control of feeding and self-stimulation. Science135, 375-377 (1962).
5.J. R. Shutter et al., Hypothalamic expression of ART, a novel gene related to agouti, is up-regulated in obese and diabetic mutant mice. Genes Dev11, 593-602 (1997).
6.M. M. Ollmann et al., Antagonism of central melanocortin receptors in vitro and in vivo by agouti-related protein. Science278, 135-138 (1997).
7.Y. Aponte, D. Atasoy, S. M. Sternson, AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nat Neurosci14, 351-355 (2011).
8.S. Luquet, F. A. Perez, T. S. Hnasko, R. D. Palmiter, NPY/AgRP neurons are essential for feeding in adult mice but can be ablated in neonates. Science310, 683-685 (2005).
9.X. Zhang, A. N. van den Pol, Rapid binge-like eating and body weight gain driven by zona incerta GABA neuron activation. Science356, 853-859 (2017).
10.W. E. L. G. B. Clark, J.; Riddoch, G.; Dott, N.M., The hypothalamus, morphological, functional, clinical and surgical aspects. The Henderson trust lectures. nos. XIII-XVI (William Ramsay Henderson trust by Oliver and Boyd, Edinburgh, London, 1938).
11.H. P. Kremer, The hypothalamic lateral tuberal nucleus: normal anatomy and changes in neurological diseases. Prog Brain Res93, 249-261 (1992).
12.H. J. Timmers, D. F. Swaab, J. A. van de Nes, H. P. Kremer, Somatostatin 1-12 immunoreactivity is decreased in the hypothalamic lateral tuberal nucleus of Huntington's disease patients. Brain Res728, 141-148 (1996).
13.H. P. Kremer, R. A. Roos, G. Dingjan, E. Marani, G. T. Bots, Atrophy of the hypothalamic lateral tuberal nucleus in Huntington's disease. J Neuropathol Exp Neurol49, 371-382 (1990).
14.K. Lewin, D. Mattingly, R. R. Millis, Anorexia nervosa associated with hypothalamic tumour. Br Med J2, 629-630 (1972).


